伯乐生命医学产品(上海)有限公司 Bio-Rad Laboratories品牌商
14 年
手机商铺
- NaN
- 0.7000000000000002
- 0.7000000000000002
- 2.7
- 2.7
伯乐生命医学产品(上海)有限公司 Bio-Rad Laboratories
入驻年限:14 年
- 联系人:
伯乐生命医学
- 所在地区:
上海 杨浦区
- 业务范围:
实验室仪器 / 设备、耗材、试剂
- 经营模式:
生产厂商
推荐产品
公司新闻/正文
qPCR实验避坑指南:9大常见错误与精准解决方案
5169 人阅读发布时间:2025-10-14 16:15

在分子生物学实验中,qPCR(实时荧光定量PCR)因其高灵敏度和准确性成为科研利器,但操作细节稍有不慎就会导致数据偏差。本文总结9个高频错误场景,结合实战经验提供针对性解决方案,助你避开 “无效实验” 陷阱,解锁可靠数据!
低质量RNA生成的cDNA会导致扩增效率低下、数据失真,堪称 “垃圾进→垃圾出” 的典型案例。
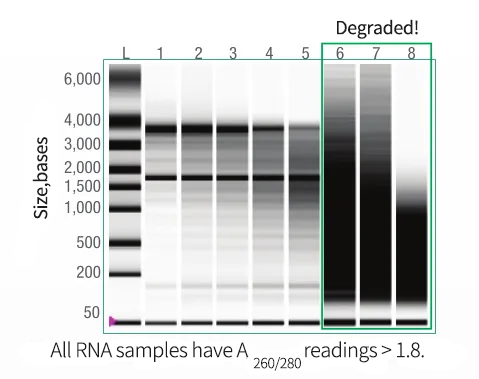
用凝胶电泳或生物分析仪严格评估RNA完整性与纯度,拒绝 “带病模板” 上机。
qPCR的扩增效率在很大程度上取决于反应容器内的各化学成分,因此每个反应都必须在完全相同的化学环境中进行。逐孔移取试剂易导致成分浓度不均,扩增效率波动可达10%-15%。
-
制备含有所有反应成分(除模板外)的预混液母液,充分混合并分配到每个反应孔中。
-
准备足够满足配置所有反应的预混液母液,并额外多准备10%,以预防可能出现的移液误差。请勿冷冻和重复使用。
如果操作PCR管时不小心,扩增DNA很容易气溶胶化。进入反应容器或试剂中的污染物会影响最终数据,导致 “假阳性” 结果,与真实生物学信号混淆。

-
戴手套并在专用的qPCR区域工作
-
使用带螺旋盖的管子制备模板
-
始终使用专用移液器进行qPCR
-
使用防气溶胶带滤芯的吸头
-
使用PCR级水
-
提前计算好PCR成分,最好一次性使用完毕
-
用10%漂白剂而不是乙醇清洁工作台
-
实验过程中始终包含无模板对照
如何知道靶标序列是否被正确扩增?如果没有对照,您就无法确定检测的特异性和准确性,也无法在出现问题时排除故障。

-
无模板对照:不添加样品,作为外源核酸污染的对照。
-
无逆转录(RT)对照: 以无反转录酶合成cDNA 的样品作为模板,每次检测都设置1个。
-
NA质量控制: 使用RNA质量检测来验证RNA的纯度和完整性。
-
阳性和阴性对照: 在反应中加入合成模板,以证明反应条件没问题。在阴性对照中不添加DNA聚合酶,以评估背景荧光信号。
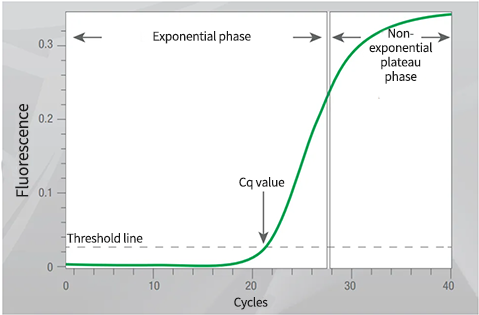
如果阈值设置在PCR反应的指数增长阶段之外,Cq值将无法准确反映样本中的DNA浓度,其结果与生物学无相关性。
-
如果反应板包括连续梯度稀释液,请将阈值调整到达到标准品最大相关系数(R2值)的位置。
-
如果反应板不包含连续梯度稀释,则将阈值置于指数扩增期,高于背景信号噪声但低于平台期。
要在qPCR检测中实现准确的模板定量,每个反应都必须有效的扩增出单一产物。扩增效率不能受以下因素的影响:
-
模板浓度
-
其他模板的扩增
-
样本中潜在的污染物
即使采用商业化检测试剂,也应进行验证。
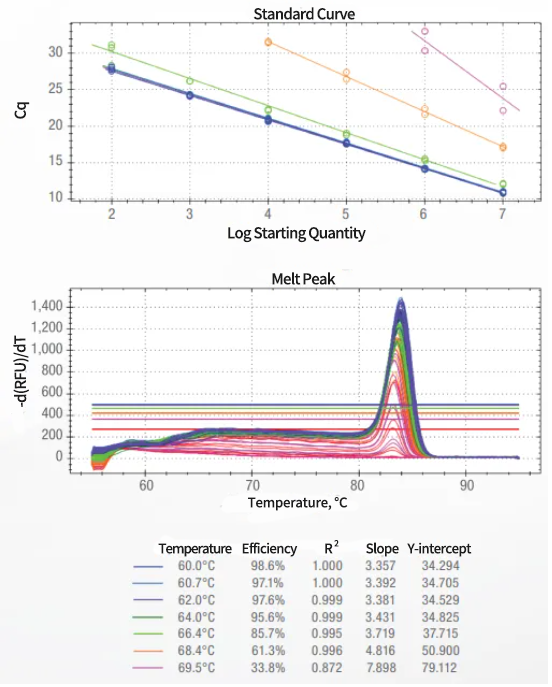
一定要验证新的qPCR检测方法,以验证其在测试条件下的扩增效率。
-
使用5个数量级(5倍或10倍稀释)的标准曲线确定PCR扩增效率,且每个梯度重复三次,以确定assay的扩增效率、线性动态范围和重现性
-
PCR的扩增效率应为90-110%
-
标准曲线的R2应大于0.98
-
重复样品的Cq值相差不应超过0.2个标准差单位(Cq值)
-
通过测试不同温度下的扩增效率和重现性,确定最佳退火温度
-
通过熔解曲线验证检测方法的特异性
标准曲线用于确定qPCR检测方法的扩增效率、线性范围和重现性。这些值仅对用于生成标准曲线的系列梯度稀释内的浓度范围有效。如果样品的Cq值超出了系列稀释液的Cq值范围,则不能推断线性范围以外的扩增效率。
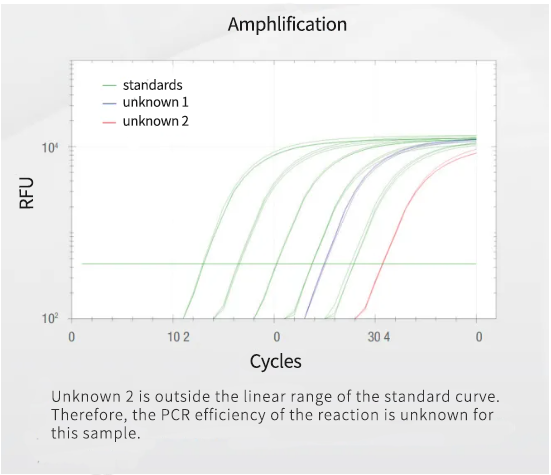
-
事先评估覆盖靶标预期浓度范围的一系列标准梯度稀释液
-
准备至少5个数量级的连续梯度稀释液(5-10倍)
-
为每个梯度稀释液移取相同体积的DNA
-
使用正确规格的移液器,尤其是小体积移液器
-
避免移液少于5µL
-
在检测污染物的阴性对照中用PCR级的水代替DNA
并非所有常用的参考基因在所有条件下都是表达稳定的。不确认参考基因的稳定性,可能会产生与所研究的生物学过程无关的结果。
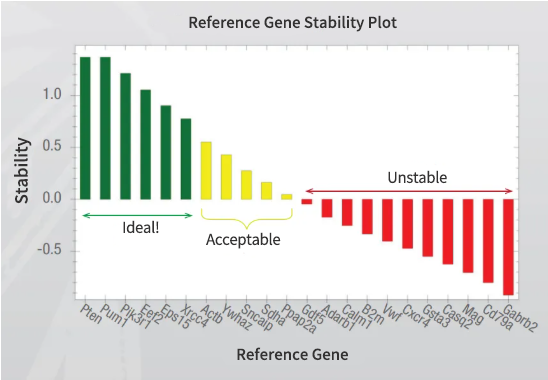
-
验证任何内参基因的适用性,确认其稳定性
-
运行一组常用内参基因的panel,以确定最适合实验条件的内参基因
-
使用多个不因实验处理或条件而改变表达量的内参基因
对每个样品进行重复检测以评估测定方法的精密度和重现性,才能对检测和实验过程有信心。
-
每个样本至少重复三份
-
进行功效分析(power analysis),以确定需要多少个重复才能得到一定的倍数变化。
* BIO-RAD是BIO-RAD LABORATORIES, INC. 在特定区域的商标。
* 本产品仅用于科研用途,不用于临床诊断。







